En química se entiende por metales a un grupo determinado de elementos situado en la parte izquierda de la Tabla Periódica de los Elementos. Los elementos de este grupo, al reaccionar químicamente con los elementos no metales, ceden a los últimos sus electrones externos o de valencia.
En la técnica se entiende por metal toda sustancia que posea "brillo metálico", propio en mayor o menor medida de todos los metales, y plasticidad. Estas propiedades las tienen no sólo los elementos puros, como el aluminio, el cobre, el hierro, etc., sino también sustancias más complejas en cuya composición pueden entrar varios elementos no metales, frecuentemente con impurezas de elementos no metales en cantidades considerables. Estas sustancias se llaman aleaciones metálicas y en una denominación más amplia pueden denominarse metales.
Cada metal se diferencia de otro por su estructura y propiedades, pero existen ciertos indicios que permiten agruparlos. En primer lugar todos los metales pueden dividirse en dos grandes grupos: metales negros y metales de color.
Metales Negros
Este grupo se caracteriza por un color gris oscuro, gran densidad, exceptuando a los metales alcalinos – ferreos, alta temperatura de fusión, dureza relativamente elevada y en muchos casos poseen polimorfismo. El metal más característico de este grupo es el hierro.
Metales Férreos
Hierro, cobalto, níquel (llamados ferromagnéticos) y el manganeso, cuyas propiedades se aproximan a las de aquellos. El cobalto, el níquel y el manganeso se emplean frecuentemente como elementos de adición a las aleaciones de hierro y como base para las correspondientes aleaciones, de propiedades parecidas a los aceros de aleación.
Metales refractarios
La temperatura de fusión de estos metales es superior que la del hierro, es decir, superior a 1539 ºC. se utilizan como elementos de adición a los aceros de aleación y como base para las correspondientes aleaciones.
Metales uránicos
Actínidos, que se utilizan principalmente en aleaciones para la energía atómica.
Metales Tierras Raras
Se incluyen en esta categoría al lantano, cerio, neodimio, praseodimio y otros agrupados bajo la denominación de lantánidos, y el itrio y el escandio, semejantes a los primeros por sus propiedades.
Estos metales poseen propiedades químicas muy próximas, pero sus propiedades físicas son bastante distintas (temperaturas de fusión y otras). Se utilizan como aditicoas a las aleaciones de otros elementos. En condiciones naturales se encuentran juntos y, debido a las dificultades que hay para separarlos en elementos aislados, se utilizan generalmente como aleación mixta, llamada “misschmetall”, que contiene entre 40 - 45 % de Ce y un 45 -50% de todos los demás elementos de tierras raras. Como aleaciones mixtas deben considerarse también el ferrocerio (aleación de cerio y hierro con otras tierras raras), el didimio y otras. Los metales alcalinotérreos, en estado metálico libre no se utilizan, a excepción de algunos casos especiales.
Metales de Color
Suelen tener una coloración roja, amarilla o blanca característica. Poseen gran plasticidad, poca dureza, temperatura de fusión relativamente baja y en ellos es característica la ausencia de polimorfismo. El metal más representativo de este grupo es el cobre.
Metales Ligeros
Caracterizados por una baja densidad, entre ellos se encuentran el Berilio, magnesio y aluminio.
Metales Nobles
Los metales de esta categoría poseen gran resistencia a la corrosión y en ella se agrupan metales como la plata, el oro y metales del grupo del platino (platino, paladio, iridio, rodio, osmio, rutenio). A ellos puede agregarse el semidoble cobre.
Metales fácilmente fusibles
En esta categoría se encuentran el zinc, cadmio, mercurio, estaño, plomo, bismuto, talio, antimonio y los elementos con propiedades metálicas debilitadas como el galio y el germanio.
Otra clasificación buena seria en metales ferrosos y no ferrosos.
Los materiales férricos son aquellos que en su composición tienen principalmente hierro, como el acero ( mezcla de hierro con un poco de carbono ) o el hierro puro.
En la imagen podemos observar bobinas de acero empleadas para la chapa de los automóviles. Sólo con
este uso, ya nos podemos imaginar la demanda tan elevada que hay de este material. Si además tenemos en cuenta que el motor del coche está fabricado básicamente por hierro, sumamos y sumamos.
red de la austenitaLa gran ventaja de este material es su precio relativamente bajo y la capacidad de unirse con otros elementos para mejorar sustancialmente sus propiedades. Veremos el caso del acero.
 Hemos representado un tipo de acero ( la estructura cristalina, o sea, como se colocan los átomos en el material )
Hemos representado un tipo de acero ( la estructura cristalina, o sea, como se colocan los átomos en el material )Las bolas grises representan los átomos de hierro y las azules los de carbono.
Al formarse la estructura ( hierro en el horno ) los átomos de hierro está moviéndose libremente. Cuando baja la temperatura es como la diana de los metales ( hay que formar filas ) y los átomos de hierro se agrupan de forma que generan ese cubo de la imagen. Como hemos añadido un poquito de carbono ( sobre el 1% ), los átomos de este no metal se “cuelan” en la formación del cubo ( red cristalina ) creando una aleación con unas propiedades mecánicas mejores.
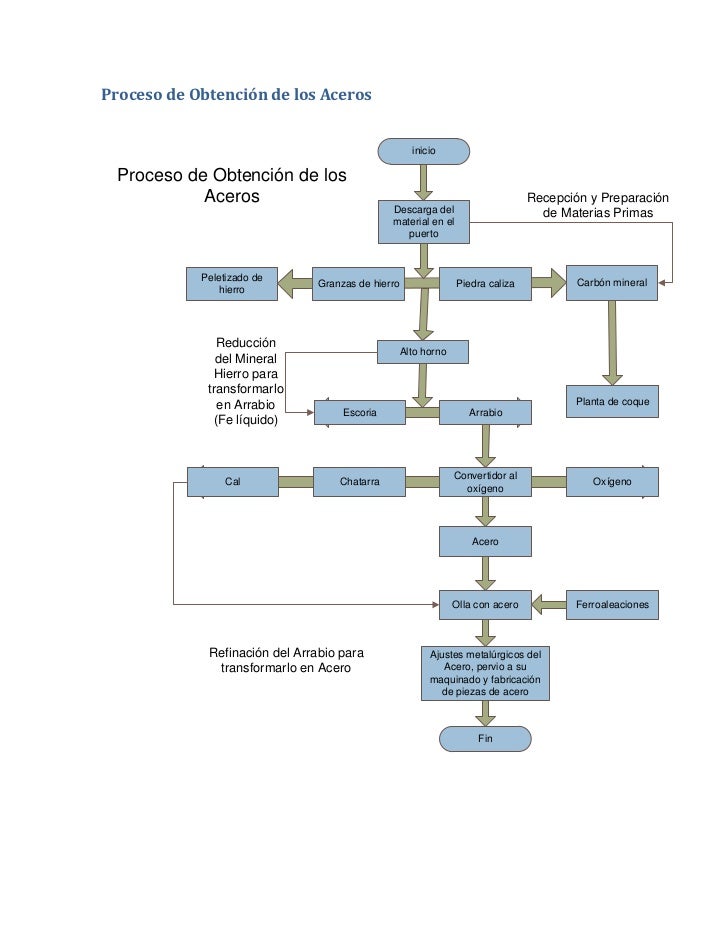
El acero: El término acero sirve comúnmente para denominar, en ingeniería metalúrgica, a una aleación de hierro con una cantidad de carbono variable entre el 0,03% y el 1,075% en peso de su composición,
dependiendo del grado. Si la aleación posee una concentración de carbono mayor al 2,0% se producen fundiciones que, en oposición al acero, son mucho más frágiles y no es posible forjarlas sino que deben ser moldeadas.
No se debe confundir el acero con el hierro, que es un metal relativamente duro y tenaz, con diámetro atómico (dA) de 2,48 Å, con temperatura de fusión de 1535 °C y punto de ebullición 2740 °C. Por su parte, el carbono es un no metal de diámetro menor (dA = 1,54 Å), blando y frágil en la mayoría de sus formas alotrópicas (excepto en la forma de diamante). La difusión de este elemento en la estructura cristalina del anterior se logra gracias a la diferencia en diámetros atómicos,, formándose un compuesto intersticial.
La diferencia principal entre el hierro y el acero se halla en el porcentaje del carbono: el acero es hierro con un porcentaje de carbono de entre el 0,03% y el 1,075%, a partir de este porcentaje se consideran otras aleaciones con hierro.
Cabe destacar que el acero posee diferentes constituyentes según su temperatura, concretamente, de mayor a menor dureza, perlita, cementita y ferrita; además de la austenita (para mayor información consultar un Diagrama Hierro-Carbono con sus constituyentes).
El acero conserva las características metálicas del hierro en estado puro, pero la adición de carbono y de otros elementos tanto metálicos como no metálicos mejora sus propiedades físico-químicas.
Metales no férricos
Cobre. Debido a su gran conductividad térmica y eléctrica, su uso queda casi exclusivamente para estos cometidos ( cables, tubos de calderas .. ) ya que no es un material barato. Se suelda con facilidad , es muy dúctil y maleable y cuando se oxida, forma una capa verdosa que le protege . En el automóvil este elemento se utiliza como conductor de la electricidad, como los coches cada vez tienen mas componentes eléctricos ahora el cobre tiene una importante función en el coche.
 Aluminio. También es un excelente conductor de la electricidad y del
Aluminio. También es un excelente conductor de la electricidad y del calor. Es muy blando con baja densidad. Como en el caso del cobre ( aunque mejor
 aún), al oxidarse forma una fina capa de óxido de aluminio que le hace enormemente resistente a la oxidación.
aún), al oxidarse forma una fina capa de óxido de aluminio que le hace enormemente resistente a la oxidación.Se usa mucho en la industria de la alimentación debido a su nula toxicidad, así como en marcos de ventanas y aplicaciones del estilo, ya que son resistentes a la humedad, radiaciones solares, etc.
En automoción tiene un monton de usos el aluminio uno de ellos es para el cárter del aceite.

Estaño
Muy blando e inoxidable. Se emplea fundamentalmente en la soldadura de cobre ( cables eléctricos y tubos de calefacción ) debido a a su bajo punto de fusión.
Otro uso es el recubrimiento de láminas de acero para fabricar la hojalata.
 Cinc: Se suele emplear junto con otros metales. Muy resistente a la corrosión, se emplea mucho en el proceso de galvanizado por el cual se añade este elemento a la capa externa del metal (
Cinc: Se suele emplear junto con otros metales. Muy resistente a la corrosión, se emplea mucho en el proceso de galvanizado por el cual se añade este elemento a la capa externa del metal ( generalmente un acero ) para crear un material muy resistente en la intemperie.
Los quita-miedos de las carreteras son otro ejemplo entre otros. La gran ventaja es que te olvidas de su mantenimiento ya que no necesita pinturas protectoras.
Enlace metálico:
Un enlace metálico es un enlace químico que mantiene unidos los átomos (unión entre núcleos atómicos y los electrones de valencia, que se juntan alrededor de éstos como una nube) de los metales entre sí.
Estos átomos se agrupan de forma muy cercana unos a otros, lo que produce estructuras muy compactas. Se trata de líneas tridimensionales que adquieren estructuras tales como: la típica de empaquetamiento compacto de esferas (hexagonal compacta), cúbica centrada en las caras o la cúbica centrada en el cuerpo.
En este tipo de estructura cada átomo metálico está dividido por otros doce átomos (seis en el mismo plano, tres por encima y tres por debajo). Además, debido a la baja electronegatividad que poseen los metales, los electrones de valencia son extraídos de sus orbitales. Este enlace sólo puede estar en sustancias en estado sólido.1
Los metales poseen algunas propiedades características que los diferencian de los demás materiales. Suelen ser sólidos a temperatura ambiente, excepto el mercurio, y tienen un punto de fusión alto.
El enlace metálico es característico de los elementos metálicos. Es un enlace fuerte, primario, que se forma entre elementos de la misma especie. Al estar los átomos tan cercanos unos de otros, interaccionan sus núcleos junto con sus nubes electrónicas, empaquetándose en las tres dimensiones, por lo que quedan los núcleos rodeados de tales nubes. Estos electrones libres son los responsables de que los metales presenten una elevada conductividad eléctrica y térmica, ya que estos se pueden mover con facilidad si se ponen en contacto con una fuente eléctrica. Los metales generalmente presentan brillo y son maleables. Los elementos con un enlace metálico están compartiendo un gran número de electrones de valencia, formando un mar de electrones rodeando un enrejado gigante de cationes. Muchos de los metales tienen puntos de fusión más altos que otros elementos no metálicos, por lo que se puede inferir que hay enlaces más fuertes entre los distintos átomos que los componen. La vinculación metálica es no polar, apenas hay diferencia de electronegatividad entre los átomos que participan en la interacción de la vinculación (en los metales, elementales puros) o muy poca (en las aleaciones), y los electrones implicados en lo que constituye la interacción a través de la estructura cristalina del metal. El enlace metálico explica muchas características físicas de metales, tales como maleabilidad, ductilidad, buenos en la conducción de calor y electricidad, y con brillo o lustre (devuelven la mayor parte de la energía lumínica que reciben).
La vinculación metálica es la atracción electrostática entre los átomos del metal o cationes y los electrones deslocalizados. Esta es la razón por la cual se puede explicar un deslizamiento de capas, dando por resultado su característica maleabilidad y ductilidad.
Los átomos del metal tienen por lo menos un electrón de valencia, no comparten estos electrones con los átomos vecinos, ni pierden electrones para formar los iones. En lugar los niveles de energía externos de los átomos del metal se traslapan. Son como enlaces covalentes identificados.
CARACTERÍSTICAS Y PROPIEDADES FÍSICAS DE LOS METALES
Su estado físico es sólido a excepción del mercurio que es líquido.
Presentan un brillo característico en su superficie (brillo metálico).
Son dúctiles (se les puede transformar en alambres) y maleables (se pueden transformar en láminas).
Son buenos conductores del calor y la electricidad.
Son tenaces (la mayoría de ellos se resisten a la ruptura).
Su densidad es elevada si se compara con las de los no metales.
Se pueden hacer aleaciones (fundir y mezclar dos o más metales).
A continuación se presentan una serie de elementos metálicos de la tabla periódica con sus principales características y propiedades físicas.
Cobre. Cobre (Cu) propiedades y características físicas
Metal de color rojizo, sólido.
Dúctil y maleable.
Tenaz.
Después del oro y la plata es el que conduce mejor calor y electricidad.
Su densidad es de 8.90 g/cm3.
Sus principales aleaciones son: latón (67% cobre y 33% zinc). Latón blanco (más de 50% de zinc con cobre). Plata nueva (Cu, Zn y Ni). Constantán (Cu y Ni) y bronce (cobre y estaño).
Plata (Ag) propiedades y características físicas
Lingotes de plata.Metal blanco puro, sólido.
Tenaz.
Muy dúctil y muy maleable.
Su densidad es de 10.5 g/cm3.
Segundo conductor del calor y la electricidad.
Sus principales aleaciones son: con plomo, oro y cobre forma aleaciones en toda proporción. Con el cobre las más usuales son: en monedas (335 y 900 partes de plata, por 165 y 100 de cobre). En orfebrería (800 a 950 milésimas de plata).
CARACTERÍSTICAS Y PROPIEDADES QUÍMICAS DE LOS METALES
Su molécula está formada por un átomo.
Sus átomos tienen 1, 2 o 3 electrones que pueden participar en un enlace químico.
Al ionozarse (proceso para producir iones; átomos con carga eléctrica) adquieren carga eléctrica positiva.
A continuación se presentan los elementos metálicos de la tabla periódica con sus principales características y propiedades químicas.
Metales de la familia 2 de los alcalinotérreos (elementos representativos)
Magnesio (Mg) propiedades químicas esenciales
Al quemarse se obtiene una llama muy brillante (se produce óxido de magnesio).
Arde también en presencia del vapor de agua, óxido de carbono, anhídrido carbónico, cloro, bromo, azufre y yodo combinándose.
Calcio (Ca) propiedades químicas esenciales
En presencia del oxígeno forma óxido de calio.
Las sales de calcio dan a la flama una coloración anaranjada.
ESTRUCTURA DE LOS METALES
Se le llama estructura de los metales a la disposición ordenada y geométrica, en el espacio, de los constituyentes de la materia en estado sólido (átomos, moléculas y grupos de moléculas). La estructura está ligada íntimamente con el comportamiento de un metal, por lo que es conveniente efectuar un estudio elemental de la misma.
Hay que considerar dos tipos de estructura, la cristalina y la granular.
Estructura Cristalina: En esta estrucutura, los átomos estánordenados en el espacio según una red geométrica constituída por la repetición de un elemento básico llamado cristal. Se conocen catorce redes espaciales distintas las cuales son las únicas formas posibles de ordenar los átomos en el espacio. La mayor parte de los metales cristalizan en las redes siguientes: cúbica centrada, cúbica centrada en las caras y hexagonal compacta.
Estructura Granular: En esta otra estructura, el elemento fundamental es el grano, constituido por agrupación de cristales.
Los granos son de forma irregular y su tamaño oscila entre 0,002 y 0,2 mm, lo cual depende pricipalmente:
Del proceso de fabricación del metal, ya que, por ejemplo, los aceros desoxidados con el aluminio son de granos más finos que los desoxidados con silicio.
De los procesos térmicos a los cuales fue sometido el metal; por ejemplo, el grano de acero, crece al calentar el material a partir de 850°C.
Cuanto mayor es el grano de que está constituido un metal, peores son, en general, sus propiedades mecánicas. Según expertos, es debido a que los materiales de nivel técnico, tales como los utilizados en la industria, contienen siempre una cantidad muy pequeña de impurezas las cuales son muy finas y frágil por lo que se concentran formando capas que envuelven los granos y los separan unos de otros.
Por una misma proporción de impurezas a repartir en la superficie de los metales resultan capas mas delgadas cuanto mas pequeños son estos, ya que la superficie total para la misma masa de metal es mayor que si los granos son grandes. Además, si las capas son muy delgadas, son en general discontinuas, quedando los granos bien unidos por las discontinuidades.
Aleaciones:
Una aleación es una combinación, de propiedades metálicas, que está compuesta de dos o más elementos, de los cuales, al menos uno es un metal.1
Las aleaciones están constituidas por elementos metálicos como Fe (hierro), Al (aluminio), Cu (cobre), Pb (plomo), ejemplos concretos de una amplia gama de metales que se pueden alear. El elemento aleante puede ser no metálico, como: P (fósforo), C (carbono), Si (silicio), S (azufre), As (arsénico).
Mayoritariamente las aleaciones son consideradas mezclas, al no producirse enlaces estables entre los átomos de los elementos involucrados. Excepcionalmente, algunas aleaciones generan compuestos químicos
Pureza:
La ley es una unidad de medida que define la pureza de los metales preciosos, describiendo la cantidad de oro o plata finos en las ligas de barras, joyas o monedas. En la antigüedad, la Edad Media y los tiempos modernos hasta la adopción del sistema métrico decimal, la ley del oro se medía en quilates y la de la plata en dineros y granos.
En el resto de los metales viene a significar lo mismo, la cantidad de el metal que se encuentra en la aleación es la pureza que tiene, cuanto mas cantidad del metal mas pureza tiene.
Historia de los metales
Antiguamente no se conocían los metales. Cuando se descubrieron y se aprendió a trabajarlos cambió la vida de los pueblos. La historia de los metales se inició hace cerca de nueve mil años en el Próximo Oriente. El primer metal utilizado fue el cobre; en Palestina y Anatolia los antiguos pobladores martillaron trozos de cobre nativo para formar herramientas. En los siguientes siglos se aprendió a extraer cobre de los minerales y mezclarlo con estaño para formar bronce.
El bronce le permitió a los imperios de la antigüedad producir armas para los ejércitos de conquista. La agricultura y la artesanía tuvieron herramientas fuertes y la producción creció. Desde entonces los metales sirvieron para muchos fines. El oro y la plata adornaron a los grandes personajes y los acompañaron en sus sepulcros. El culto religioso se sirvió de ellos para elaborar ornamentos y símbolos.
Nuevos procesos técnicos hicieron posible utilizar otros metales: herramientas y armas más fuertes, edificios reforzados con ganchos y puertas con cerraduras y herrajes. El hierro le dio a las naciones que lo producían una gran ventaja; en estos reinos los gobernantes demandaron más y mejores adornos. Crecieron así, lado a lado, la metalurgia del bronce y el hierro y la orfebrería del oro y la plata.
Para el 1000 antes de Cristo casi todos los pueblos del Viejo Mundo tenían metales; desde el Mediterráneo, pasando por Persia e India, se hicieron en bronce y oro armas, instrumentos y adornos variados. Desde China la metalurgia se extendió a Japón, en donde los aceros armaron a los samuráis, y también al sureste asiático cuyos templos se coronaron con cúpulas doradas.
Para la época en que cayó el Imperio Romano los implementos de metal eran parte de la vida diaria. Ya no se podía entender el comercio sin la moneda ni las actividades cotidianas sin herramientas metálicas. Las religiones del mundo antiguo en Asia, África y Europa, recurrieron al oro y la plata para forjar los objetos sagrados. En el convulsionado mundo medieval chocaron en la guerra los metales de Occidente y los de Oriente.
Desde 1300 los estados del occidente de África, al sur del Sahara, usaron el bronce para decorar las ciudadelas reales. Para surtir de materias primas a los herreros y distribuir sus productos se organizaron caravanas que cruzaban el desierto. Los orfebres africanos se convirtieron en maestros de la fundición; los adornos y delicadas miniaturas comunican una profunda simbología.
Los antiguos suramericanos empezaron a trabajar el cobre y el oro alrededor de 1500 antes de Cristo. Unos mil años más tarde varias culturas andinas adornaban a sus líderes con suntuosos atuendos. El oro y la plata se reservaron para los gobernantes y la religión; los objetos rituales y simbólicos comunicaban una visión del mundo que compartía toda la sociedad.
En el año 500 de nuestra era la metalurgia ya era una actividad corriente desde México central hasta el norte de Chile y Argentina. En cada región surgieron estilos propios: en México, figuras en lámina; en Centroamérica, pequeños adornos de oro; en Colombia y Ecuador, adornos de tumbaga dorada; en Perú, coloridos atuendos de cobre dorado y plateado; en los Andes del sur, placas de bronce.
La metalurgia en la Colombia prehispánica fue, ante todo, orfebrería. En dos mil años surgieron muchos estilos diferentes y se fabricaron miles de piezas para el ritual y la ofrenda. Los indígenas manejaron con maestría el oro, el cobre, la tumbaga y el platino. La conquista europea, en 1500, truncó este desarrollo y causó la desaparición de la producción orfebre.
En los últimos 300 años la producción de metales ha tenido un gran avance. La gran industria usa millones de toneladas de metales cada año; también las sociedades no industriales consumen cada vez más metales para los más variados propósitos. La historia de la humanidad en los últimos nueve mil años es la historia de los metales: con ellos hemos construido el mundo en que vivimos.
A qui os dejo un link de un vídeo donde lo explican.
http://vimeo.com/9691630
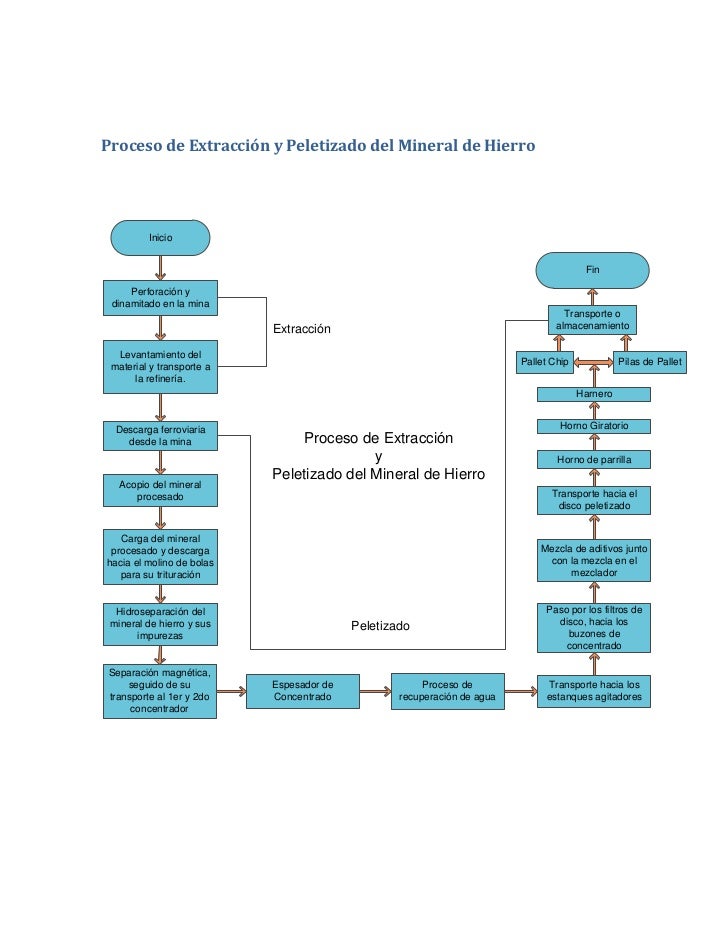
Extracción, producción y reciclado de los metales
En el proceso de extracción minera se utilizan diferentes métodos y técnicas, veamos algunos de ellos:
Extracción de mineral a cielo abierto: se realiza cuando el yacimiento puede ser explotado en la superficie; tales son los casos de las minas de hierro en Cerro Bolívar y El Pao o las minas de bauxita en Los Pijiguaos en Guayana.
Extracción de mineral del subsuelo: cuando se trata de excavar a cierta profundidad para extraer el rnineral, por lo general el carbón se extrae en esa forma.
Extracción por cernido: se refiere a la búsqueda de minerales en la tierra o arena, cerniéndola y pasándola por corrientes de agua como lo hacen los mineros al buscar diamantes u otras piedras preciosas.
Extracción por bombeo: se refiere a la remoción de grandes cantidades de arena desde el fondo de los ríos para obtener diamantes, otras piedras preciosas u oro.
Proceso de reciclado:
Se recogen y clasifican los diferentes metales.
Las latas de aluminio y acero se comprimen para llevarlas a la planta de reciclado.
Las latas comprimidas se meten en una trituradora para desmenuzarlas.
Un enorme imán que se sitúa sobre el metal, separa el acero del aluminio. Los dos metales tendrán una aventura diferente en su proceso de reciclaje.
El aluminio se funde y se moldea en lingotes de 25 toneladas.
Los lingotes de aluminio se funden y se pasan por rodillos para formar laminas finas, haciendo así latas nuevas.
En el caso de acero por ejemplo, las latas de conserva están formadas un 99% de acero, forrado en el interior con una fina capa de estaño evitando así la oxidación del material que contienen.
Se colocan estas latas en un cubo con agua sometiéndolo a electricidad y sustancias químicas, la reacción obtenida es que el estaño flota separándolo del acero. Para continuar el proceso de reciclaje
El acero puro se lava e introduce en la fundidora para hacer lingotes.
Los lingotes de acero se funden y pasan por rodillos para así formar laminas finas en hojas delgadas para latas nuevas.
Oxidación y corrosión
Los materiales están expuestos continuamente a los más diversos ambientes de
interacción material-ambiente provoca, en muchos casos, la pérdida o deterioro de las
propiedades físicas del material. Los mecanismos de deterioro son diferentes según
se trate de materiales metálicos, cerámicos o polímeros (plásticos). Así, en el hierro,
en presencia de la humedad y del aire, se transforma en óxido, y si el ataque continúa
acaba destruyéndose del todo. Desde el punto de vista económico, la corrosión
ocasiona pérdidas muy elevadas.
En los materiales metálicos, el proceso de deterioro se llama oxidación y
corrosión. Por otro lado, en los cerámicos las condiciones para el deterioro han de ser
extremas, y hablaremos también de corrosión. Sin embargo, la pérdida de las
propiedades de los materiales polímeros se denomina degradación.
En el deteriores de materiales podemos distinguir dos procesos:Los materiales están expuestos continuamente a los más diversos ambientes de
interacción material-ambiente provoca, en muchos casos, la pérdida o deterioro de las
propiedades físicas del material. Los mecanismos de deterioro son diferentes según
se trate de materiales metálicos, cerámicos o polímeros (plásticos). Así, en el hierro,
en presencia de la humedad y del aire, se transforma en óxido, y si el ataque continúa
acaba destruyéndose del todo. Desde el punto de vista económico, la corrosión
ocasiona pérdidas muy elevadas.
En los materiales metálicos, el proceso de deterioro se llama oxidación y
corrosión. Por otro lado, en los cerámicos las condiciones para el deterioro han de ser
extremas, y hablaremos también de corrosión. Sin embargo, la pérdida de las
propiedades de los materiales polímeros se denomina degradación.
En el deteriores de materiales podemos distinguir dos procesos:
Oxidación directa: Resulta de la combinación de los átomos metálicos con los de
la sustancia agresiva. Ejemplos:
2 Fe + O2 2 FeO (herrumbre-óxido) (oxidación por oxígeno como causa) →
Fe + S FeS (sulfuro) (oxidación por azufre como causa) →
Esto lleva a que el metal, con el tiempo, pase de tener un estado libre
(puro) a tener un estado combinado con otros elementos (óxidos, carbonatos,
sulfatos,...)
En este caso, los productos de la reacción quedan adheridos a la
superficie del metal. En algunos casos, se forman películas protectoras que los
aislan del agente corrosivo. El caso más corriente es el ataque por oxígeno. En
este caso, sobre el metal se forma una capa de óxido que, en algunos casos
autoprotege al metal de una mayor oxidación. Cu, Ni, Sn, Al, Cr,... Los ambientes
son secos.
Pero el oxígeno no es el único agente, pues también puede intervenir el
cloro (Cl2), el azufre (S), el hidrógeno (H2), el monóxido de carbono (CO), el
dióxido de carbono (CO2),...
En los procesos de oxidación, los metales pasan de su estado elemental a
formar iones positivos (cationes) por pérdida de electrones.
El proceso de oxidación se acelera si la temperatura de eleva
Corrosión electroquímica o corrosión en líquidos. En este caso, el metal es
atacado por un agente corrosivo en presencia de un un electrolito. (Un
electrólito o electrolito es cualquier sustancia, normalmente líquida, que
contiene iones libres, que se comportan como un medio conductor eléctrico.
Normalmente un electrolito es una disolución, en la que el disolvente suele ser
agua y el soluto otra sustancia). El ejemplo más conocido es el agua del mar (el
cloruro sódico es un agente corrosivo), que actúa como electrolito.
Los procesos de corrosión son procesos electroquímicos, ya que en la superficie
del metal se generan “micropilas galvánicas” en las que la humedad actúa como
electrolito. El metal actúa como ánodo (polo positivo) y, por lo tanto, se disuelve. Así,
el electrolito actúa como medio conductor a través del cual viajan las cargas que
abandonan los electrones del ánodo que se corroe, el metal.
Existe un tipo de corrosión de tipo electroquímico que aparece cuando se juntan
metales diferentes o son conectados eléctricamente. Al producirse el contacto, el
metal más electronegativo desempeña el papel de ánodo y, por tanto, sufre la
corrosión.
Definiciones que te aclaran las cosas:
a) Ánodo: Metal que cede electrones y se corroe.
b) Cátodo: Receptor de electrones.
c) Electrolito: Líquido que está en contacto con el ánodo y el cátodo. Debe ser
conductor eléctrico. Este líquido proporciona el medio a través del cual se asegura el
desplazamiento de cargas eléctricas desde el ánodo hasta el cátodo








hola! es muy interesante lo que has escrito pero ahora como puedo citarte si tomo tu informacion??
ResponderEliminar¿Está buscando un prestamista de préstamos positivo para solucionar su problema financiero? Entonces le gustaría que pedro ofreciera un préstamo, pedro me ofreciera un préstamo a una tasa de 3 roi y todo el proceso se desarrolló sin problemas como esperaba, puede enviarle un correo electrónico si necesita algún tipo de préstamos email: pedroloanss@gmail.com o whatsapp: +18632310632
ResponderEliminar