No se debe confundir el acero con el hierro, la diferencia principal entre el hierro y el acero se halla en el porcentaje del carbono: el acero es hierro con un porcentaje de carbono de entre el 0,03% y el 1,075%, a partir de este porcentaje se consideran otras aleaciones con hierro.
Microconstituyentes De Aceros No Aleados.
Ferrita.
Cementita.
Perlita.
Microconstituyentes De Aceros No Aleados Templados.
Martensita.
Estructuras intermedias (Sorbita, Troostita y Bainita).
Otros Microconstituyentes.
Además de los microconstituyentes comentados, los aceros no aleados presentan en sus microestructuras otros elementos de interés. Entre los que se encuentran más comúnmente, destacan las impurezas, óxidos e inclusiones resultado de la deficiente desoxidación y refino de los mismos. Los óxidos se producen en la superficie de la pieza generalmente, aunque pueden existir ciertos procesos de oxidación interna que los hacen aparecer de color gris pálido a gris oscuro según el tiempo de pulido empleado. Entre las inclusiones destacan las de silicatos y las de sulfuros, principalmente de Mn, que aparecen como granos alargados en la dirección de laminación, con coloraciones oscuras y gris paloma, respectivamente. La observación de estos microconstituyentes es conveniente realizarla previamente al ataque de la probeta metalográfica.
 El acero presenta distintas estructuras cristalinas dependiendo básicamente de a que temperatura se encuentre y que porcentaje de carbono contenga. Todas las estructuras que puede presentar el acero están especificadas en el diagrama de hierro carbono, el cual en el eje horizontal tiene el contenido de carbono y
El acero presenta distintas estructuras cristalinas dependiendo básicamente de a que temperatura se encuentre y que porcentaje de carbono contenga. Todas las estructuras que puede presentar el acero están especificadas en el diagrama de hierro carbono, el cual en el eje horizontal tiene el contenido de carbono y en el eje vertical la temperatura.
Para complicar aun mas las cosas, el acero también puede presentar estructuras metaestables dependiendo de que tan rápido o lento haya sido el proceso de enfriamiento.
Algunas de las estructuras estables son: perlita, ferrita alfa, ferrita gamma, ledeburita y cementita. Algunas de las estructuras metaestables son: martensita (es la estructura del acero templado), bainita, troostita.
La diferencia entre estas estructuras es la forma en la que se solubiliza, combina y precipita el carbono
Como veras este es un tema muy interesante y extenso, por lo cual te recomiendo que leas cualquier libro de ciencias de los materiales, el cual te permitirá conocer las estructuras básicas.
PROPIEDADES FÍSICAS DEL ACERO:
Aunque es difícil establecer las propiedades físicas y mecánicas del acero debidoa que estas varían con los ajustes en su composición y los diversos tratamientostérmicos, químicos o mecánicos, con los que pueden conseguirse aceros concombinaciones de características adecuadas para infinidad de aplicaciones, sepueden citar algunas propiedades genéricas:
Su densidad media es de 7850 kg/m³. En función de la temperatura el acero sepuede contraer, dilatar o fundir.
El punto de fusión del acero depende del tipo de aleación y los porcentajes deelementos aleantes. El de su componente principal, el hierro es de alrededorde 1.510 °C en estado puro (sin alear), sin embargo el acero presentafrecuentemente temperaturas de fusión de alrededor de 1.375 °C, y en generalla temperatura necesaria para la fusión aumenta a medida que se aumenta elporcentaje de carbono y de otros aleantes, (excepto las aleaciones auténticasque funden de golpe). Por otra parte el acero rápido funde a 1.650 °C. Su puntode ebullición es de alrededor de 3.000 °C.
PROPIEDADES MECÁNICAS DEL ACERO
Tenacidad:
Es la capacidad que tiene un material de absorber energía sin producir fisuras(resistencia al impacto). El acero es un material muy tenaz, especialmente enalguna de las aleaciones usadas para fabricar herramientas.
Ductilidad:
Es relativamente dúctil. Con él se obtienen hilos delgados llamados alambres.Un aumento de la temperatura en un elemento de acero provoca un aumentoen la longitud del mismo. Este aumento en la longitud puede valorarse por la
expresión: δL = α δ t° L, siendo a el coeficiente de dilatación, que para el acero
vale aproximadamente 1,2 ·
10−5 (es decir α = 0,000012).
El acero se dilata y se contrae según un coeficiente de dilatación similar alcoeficiente de dilatación del hormigón, por lo que resulta muy útil su usosimultáneo en la construcción, formando un material compuesto que sedenomina hormigón armado.
Maleable:
Se pueden obtener láminas delgadas llamadas hojalata. La hojalata es unalamina de acero, de entre 0,5 y 0,12 mm de espesor, recubierta, generalmentede forma electrolítica, por estaño.
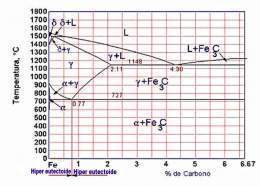
DIAGRAMA HIERRO-CARBONO
Diagrama hierro(Fe) carbono(C): También llamado de equilibrio o de fases Fe-C se emplea para la representación de las transformaciones que sufren los aceros al carbono con la temperatura, admitiendo que el calentamiento (o enfriamiento) de la mezcla se realiza muy lentamente de modo que los procesos de difusión (homogeneización) tienen tiempo para completarse.
Orígen
El estado actual del diagrama de equilibrio de las aleacioneshierro-carbono fue establecido como resultado de las investigaciones hechas por varios científicos. La elaboración de este diagrama fue empezada por D. Chernov, quien estableció en 1968 los puntos críticos del acero.
Más tarde volvió a estudiar reiteradamente este diagrama. N. Gutovski, M. Wittorft, Roberts Austen, Roozebomhicieron una gran aportación al estudio de este diagrama. Los últimos datos acerca del diagrama están expuestos en las obras de I. Kornilov.
Generalidades del diagrama Fe-C
Las aleaciones hierro-carbono pertenecen al tipo de aleaciones que forman una composición química. El carbono se puede encontrar en las aleaciones hierro-carbono, tanto en estado ligado (Fe3C), como en estado libre (C, es decir, grafito), por eso, el diagrama comprende dos sistemas:
Fe-Fe3C(metalestable): Este sistema está representado en el diagrama con líneas llenas gruesas y comprende aceros y fundiciones blancas, o sea, las aleaciones con el carbono ligado, sin carbono libre (grafito).
Fe-C (estable): En el diagrama se representa con líneas punteadas; este sistema expone el esquema de formación de las estructuras en las fundiciones grises y atruchadas donde el carbono se encuentra total o parcialmente en estado libre (grafito).
Para estudiar las transformaciones que tienen lugar en aceros y fundiciones blancas se emplea el diagrama Fe-Fe3C, y para estudiar fundiciones grises, ambos diagramas (Fe-Fe3C y Fe-C).
La temperatura a que tienen lugar los cambios alotrópicos en el hierro está influida por elementos de aleación, de los cuales el más importante es el carbono. Esta la parte entre hierro puro y un compuesto intersticial, carburo de hierro, que contiene 6.67 % de carbono por peso; por tanto, esta porción se llamará diagrama de equilibrio hierro - carburo de hierro. Este no es un verdadero diagrama de equilibrio, pues el equilibrio implica que no hay cambio de fase con el tiempo; sin embargo, es un hecho que el compuesto carburo de hierro se descompondrá en hierro y carbono (grafito).
Las reacciones eutéticas y eutectoides difieren entre sí, en más de un aspecto importante. Las reacciones eutéticas implican el paso de una fase líquida a dos fases sólidas mientras que las reacciones eutectoides se efectúa totalmente dentro del estado sólido.
Fases y constituyentes
Fases y constituyentes
El hierro puro presenta tres estados alotrópicos a medida que se incrementa la temperatura desde la temperatura ambiente:
Hasta los 911 °C (temperatura crítica AC3), el hierro ordinario, cristaliza en el sistema cúbico de cuerpo centrado y recibe la denominación de hierro α o ferrita.
Es un material dúctil y maleable responsable de la buena forjabilidad de la aleaciones con bajo contenido en carbono y esferromagnético hasta los 770 °C (temperatura de Curie a la que pierde dicha cualidad; se suele llamar también AC2). La ferrita puede disolver pequeñas cantidades de carbono.
Entre 911 y 1400 °C cristaliza en el sistema cúbico de caras centradas y recibe la denominación de hierro γ o austenita.
Dada su mayor compacidad la austenita se deforma con mayor facilidad y es paramagnética.
Entre 1400 y 1538 °C cristaliza de nuevo en el sistema cúbico de cuerpo centrado y recibe la denominación de hierro δ
que es en esencia el mismo hierro alfa pero con parámetro de red mayor por efecto de la temperatura.
A mayor temperatura el hierro se encuentra en estado líquido. Si se añade carbono al hierro, sus átomos podrían situarse simplemente en los instersticios de la red cristalina de éste último; sin embargo en los aceros aparece combinado formando carburo de hierro (Fe3C), es decir, un compuesto químico definido y que recibe la denominación de cementita de modo que los aceros al carbono están constituidos realmente por ferrita y cementita.
Además de éstos, existen otros dos constituyentes, la ledeburita y la perlita. La primera es el nombre que se da a la composición eutética sólida; se presenta únicamente en el hierro colado y, después de la transformación que se lleva a cabo al enfriarse a la temperatura ambiente, adquiere un aspecto moteado. La lebedurita transformada consiste en colonias de perlita en una red continua (llamada matriz) de cementita.
La perlita es un constituyente muy importante que se encuentra tanto en el acero como en el hierro colado. La perlita tiene valores de dureza y ductilidad intermedios a los de la ferrita y la cementita.
Otros constituyentes
Las texturas básicas descritas (perlíticas) son las obtenidas enfriando lentamente aceros al carbono, sin embargo modificando las condiciones de enfriamiento (base de los tratamientos térmicos) es posible obtener estructuras cristalinas diferentes:
La martensita es el constituyente típico de los aceros templados y se obtiene de forma casi instantánea al enfriar rápidamente la austenita. Es una solución sobresaturada de carbono en hierro alfa con tendencia, cuanto mayor es el carbono, a la sustitución de la estructura cúbica centrada en el cuerpo por tetragonal centrada en el cuerpo. Tras la cementita (y los carburos de otros metales) es el constituyente más duro de los aceros.
Velocidades intermedias de enfriamiento dan lugar a la bainita, estructura similar a la perlita formada por agujas de ferrita y cementita pero de mayor ductilidad y resistencia que aquélla.
También se puede obtener austenita por enfriamiento rápido de aleaciones con elementos gammágenos (que favorecen la estabilidad del hierro γ) como el níquel y el manganeso, tal es el caso por ejemplo de losaceros inoxidables austeníticos.
Antaño se identificaron también la sorbita y la troostita que han resultado ser en realidad perlitas de muy pequeña distancia interlaminar por lo que dichas denominaciones han caído en desuso.
Transformación de la austenita
El diagrama de fases Fe-C muestra dos composiciones singulares
Eutéctico
Composición para la cual el punto de fusión es mínimo que se denomina ledeburita y contiene un 4,3% de carbono (64,5 % de cementita). La ledeburita aparece entre los constituyentes de la aleación cuando el contenido en carbono supera el 2% (región del diagrama no mostrada) y es la responsable de la mala forjabilidad de la aleación marcando la frontera entre los aceros con menos del 2% de C (forjables) y las fundiciones con porcentajes de carbono superiores (no forjables y fabricadas por moldeo).
De este modo se observa que por encima de latemperatura crítica A3[1] los aceros están constituidos sólo por austenita, una solución sólida de carbono en hierro γ y su microestructura en condiciones de enfriamiento lento dependerá por tanto de las transformaciones que sufra ésta.
Eutectoide
Un eutectoide en la zona de los aceros, equivalente al eutéctico pero en estado sólido, donde la temperatura de transformación de la austenita es mínima. El eutectoide contiene un 0,77 %C (13,5% de cementita) y se denomina perlita. Está constituido por capas alternas de ferrita y cementita, siendo sus propiedades mecánicas intermedias entre las de la ferrita y la cementita.
La existencia del eutectoide permite distinguir dos tipos de aleaciones de acero:
Aceros hipoeutectoides (< 0,77% C): Al enfriarse por debajo de la temperatura crítica A3 comienza a precipitar la ferrita entre los granos (cristales) de austenita y al alcanzar la temperatura crítica A1 la austenita restante se transforma en perlita. Se obtiene por tanto a temperatura ambiente una estructura de cristales de perlita embebidos en una matriz de ferrita.
Aceros hipereutectoides (>0,77% C): Al enfriarse por debajo de la temperatura crítica se precipita el carburo de hierro resultando a temperatura ambiente cristales de perlita embebidos en una matriz de cementita.
Clasificación de los aceros
Los aceros se pueden clasficiar en función de varios criterios, esto da lugar a varias clasificaciones, la más utilizada de todas ellas es la clasificación en función del porcentaje de carbono disuelto:
El porcentaje de carbono disuelto en el acero condiciona las propiedades del mismo. Así cuanto mayor sea el porcentaje de carbono disuelto en el acero, éste presenta más dureza y más resistencia a la tracción. Teniendo esto presente es posible clasificar los aceros en:
Por otro lado es posible hablar de aceros aleados y aceros no aledos. Se consideran aceros no aleados aquellso en los cuales el porcentaje de elementos químicos que forman el acero no supera el valor indicado en la siguiente tabla:
Aquellos aceros que tienen mayor porcentaje de los indicados en las tablas son requeridos para utilizaciones especiales, y están recogidos en las normas UNE
Tamaño del grano
Conforme aumentamos el tiempo de
recocido, el número del tamaño del grano según
ASTM, disminuye; y conforme a esto, van variando
las propiedades mecánicas de los distintos materiales.
En todos los aceros inoxidables austeníticos estudiados,
tanto estables como metaestables, se observa
la misma tónica: a mayor número de tamaño
de grano (tamaño de grano más pequeño), mayores
valores se obtienen de límite elástico al 0,2 %,
de resistencia a la tracción^^ y de dureza, y menores
valores se obtienen en cuanto a los alargamientos.
Tomando como referencia un tamaño de grano
igual a siete, observamos que los aceros metaestables
tienen menores valores de límite elástico al
0,2 % que los estables; mientras que, en cuanto a
alargamientos y resistencias a la tracción tienen
valores mayores, siendo las durezas muy similares.
Esto puede atribuirse a las cantidades de manganeso,
molibdeno y níquer que son mayores en losaceros
inoxidables austeníticos estables. También
influirá el tiempo de recocido, ya que en los aceros
estables se consigue este tamaño de grano a mayor
tiempo, 12 min, que en los metaestables, que se
consigue con 200 s de recocido.
Elementos aleantes del acero y mejoras obtenidas con la aleación
Aunque la composición química de cada fabricante de aceros es casi secreta, certificando a sus clientes solo la resistencia y dureza de los aceros que producen, sí se conocen los compuestos agregados y sus porcentajes admisibles
Aluminio: se emplea como elemento de aleación en los aceros de nitruracion, que suele tener 1% aproximadamente de aluminio. Como desoxidante se suele emplear frecuentemente en la fabricación de muchos aceros. Todos los aceros aleados en calidad contienen aluminio en porcentajes pequeñísimos, variables generalmente desde 0,001 a 0,008%.
Boro: logra aumentar la capacidad de endurecimiento cuando el acero está totalmente desoxidado.
Cobalto: muy endurecedor. Disminuye la templabilidad. Mejora la dureza en caliente. El cobalto es un elemento poco habitual en los aceros.Se usa en los aceros rápidos para herramientas, aumenta la dureza de la herramienta en caliente. Se utiliza para aceros refractarios. Aumenta las propiedades magnéticas de los aceros.
Cromo: es uno de los elementos especiales más empleados para la fabricación de aceros aleados, usándose indistintamente en los aceros de construcción, en los de herramientas, en los inoxidables y los de resistencia en caliente. Se emplea en cantidades diversas desde 0.30% a 30%, según los casos y sirve para aumentar la dureza y la resistencia a la tracción de los aceros, mejora la templabilidad, impide las deformaciones en el temple, aumenta la resistencia al desgaste, la inoxidabilidad, etc.Forma carburos muy duros y comunica al acero mayor dureza, resistencia y tenacidad a cualquier temperatura. Solo o aleado con otros elementos, proporciona a los aceros características de inoxidables y refractarios; también se utiliza en revestimientos embellecedores o recubrimientos duros de gran resistencia al desgaste, como émbolos, ejes, etc.
Estaño: es el elemento que se utiliza para recubrir láminas muy delgadas de acero que conforman la hojalata.
Manganeso: aparece prácticamente en todos los aceros, debido, principalmente, a que se añade como elemento de adición para neutralizar la perniciosa influencia del azufre y del oxigeno, que siempre suelen contener los aceros cuando se encuentran en estado líquido en los hornos durante los procesos de fabricación. El manganeso actúa también como desoxidante y evita, en parte, que en la solidificación del acero que se desprendan gases que den lugar a porosidades perjudiciales en el material.Si los aceros no tuvieran manganeso, no se podrían laminar ni forjar, porque el azufre que suele encontrarse en mayor o menor cantidad en los aceros, formarían sulfuros de hierro, que son cuerpos de muy bajo punto de fusión (981º aprox.) que a las temperaturas de trabajo en caliente (forja o laminación) funden, y al encontrarse contorneando los granos de acero crean zonas de debilidad y las piezas y barras se abren en esas operaciones de transformación. Los aceros ordinarios y los aceros aleados en los que el manganeso no es elemento fundamental, suelen contener generalmente porcentajes de manganeso variables de 0,30 a 0,80%.
Molibdeno: es un elemento habitual del acero y aumenta mucho la profundidad de endurecimiento de acero, así como su tenacidad. Los aceros inoxidables austeníticos contienen molibdeno para mejorar la resistencia a la corrosión.
Nitrógeno: se agrega a algunos aceros para promover la formación de austenita.
Níquel: una de las mayores ventajas que reporta el empleo del níquel, es evitar el crecimiento del grano en los tratamientos térmicos, lo que sirve para producir en ellos gran tenacidad. El níquel además hace descender los puntos críticos y por ello los tratamientos pueden hacerse a temperaturas ligeramente más bajas que la que corresponde a los aceros ordinarios. Experimentalmente se observa que con los aceros aleados con níquel se obtiene para una misma dureza, un limite de elasticidad ligeramente más elevado y mayores alargamientos y resistencias que con los aceros al carbono o de baja aleación. En la actualidad se ha restringido mucho su empleo, pero sigue siendo un elemento de aleación indiscutible para los aceros de construcción empleados en la fabricación de piezas para máquinas y motores de gran responsabilidad, se destacan sobre todo en los aceros cromo-níquel y cromo-níquel-molibdeno.El níquel es un elemento de extraordinaria importancia en la fabricación de aceros inoxidables y resistentes a altas temperaturas, en los que además de cromo se emplean porcentajes de níquel variables de 8 a 20%. Es el principal formador de austenita, que aumenta la tenacidad y resistencia al impacto. El níquel se utiliza mucho para producir acero inoxidable, porque aumenta la resistencia a la corrosión.
Plomo: el plomo no se combina con el acero, se encuentra en él en forma de pequeñísimos glóbulos, como si estuviese emulsionado, lo que favorece la fácil mecanización por arranque de viruta, (torneado, cepillado, taladrado, etc.) ya que el plomo es un buen lubricante de corte, el porcentaje oscila entre 0.15 y 0.30 % debiendo limitarse el contenido de carbono a valores inferiores al 0.5 % debido a que dificulta el templado y disminuye la tenacidad en caliente.se añade a algunos aceros para mejorar mucho la maquinabilidad.
Silicio: aumenta moderadamente la templabilidad. Se usa como elemento desoxidante. Aumenta la resistencia de los aceros bajos en carbono.
Titanio: se usa para estabilizar y desoxidar el acero.
Tungsteno: también conocido como wolframio. Forma con el hierro carburos muy complejos estables y durísimos, soportando bien altas temperaturas. En porcentajes del 14 al 18 %, proporciona aceros rápidos con los que es posible triplicar la velocidad de corte de loa aceros al carbono para herramientas.
Vanadio: posee una enérgica acción desoxidante y forma carburos complejos con el hierro, que proporcionan al acero una buena resistencia a la fatiga, tracción y poder cortante en los aceros para herramientas.
Zinc: es elemento clave para producir chapa de acero galvanizado.
Los porcentajes de cada uno de los aleantes que pueden configurar un tipo determinado de acero están normalizados.
Tratamientos térmicos del acero
El tratamiento térmico en el material es uno de los pasos fundamentales para que pueda alcanzar las propiedades mecánicas para las cuales está creado. Este tipo de procesos consisten en el calentamiento y enfriamiento de un metal en su estado sólido para cambiar sus propiedades físicas. Con el tratamiento térmico adecuado se pueden reducir los esfuerzos internos, el tamaño del grano, incrementar la tenacidad o producir una superficie dura con un interior dúctil. La clave de los tratamientos térmicos consiste en las reacciones que se producen en el material, tanto en los aceros como en las aleaciones no férreas, y ocurren durante el proceso de calentamiento y enfriamiento de las piezas, con unas pautas o tiempos establecidos.
Para conocer a que temperatura debe elevarse el metal para que se reciba un tratamiento térmico es recomendable contar con los diagramas de cambio de fases como el del hierro-carbono. En este tipo de diagramas se especifican las temperaturas en las que suceden los cambios de fase (cambios de estructura cristalina), dependiendo de los materiales diluidos.
Los tratamientos térmicos han adquirido gran importancia en la industria en general, ya que con las constantes innovaciones se van requiriendo metales con mayores resistencias tanto al desgaste como a la tensión. Los principales tratamientos térmicos son:
Temple: Su finalidad es aumentar la dureza y la resistencia del acero. Para ello, se calienta el acero a una temperatura ligeramente más elevada que la crítica superior Ac (entre 900-950 °C) y se enfría luego más o menos rápidamente (según características de la pieza) en un medio como agua, aceite, etcétera.
Revenido: Sólo se aplica a aceros previamente templados, para disminuir ligeramente los efectos del temple, conservando parte de la dureza y aumentar la tenacidad. El revenido consigue disminuir la dureza y resistencia de los aceros templados, se eliminan las tensiones creadas en el temple y se mejora la tenacidad, dejando al acero con la dureza o resistencia deseada. Se distingue básicamente del temple en cuanto a temperatura máxima y velocidad de enfriamiento.
Recocido: Consiste básicamente en un calentamiento hasta la temperatura de austenización (800-925 °C) seguido de un enfriamiento lento. Con este tratamiento se logra aumentar la elasticidad, mientras que disminuye la dureza. También facilita el mecanizado de las piezas al homogeneizar la estructura, afinar el grano y ablandar el material, eliminando la acritud que produce el trabajo en frío y las tensiones internas.
Normalizado: Tiene por objetivo dejar un material en estado normal, es decir, ausencia de tensiones internas y con una distribución uniforme del carbono. Se suele emplear como tratamiento previo al temple y al revenido.
Tratamientos termoquímicos del acero
Los tratamientos termoquímicos son tratamientos térmicos en los que, además de los cambios en la estructura del acero, también se producen cambios en la composición química de la capa superficial, añadiendo diferentes productos químicos hasta una profundidad determinada. Estos tratamientos requieren el uso de calentamiento y enfriamiento controlados en atmósferas especiales.
Entre los objetivos más comunes de estos tratamientos están aumentar la dureza superficial de las piezas dejando el núcleo más blando y tenaz, disminuir el rozamiento aumentando el poder lubrificante, aumentar la resistencia al desgaste, aumentar la resistencia a fatiga o aumentar la resistencia a la corrosión.
Cementación (C): aumenta la dureza superficial de una pieza de acero dulce, aumentando la concentración de carbono en la superficie. Se consigue teniendo en cuenta el medio o atmósfera que envuelve el metal durante el calentamiento y enfriamiento. El tratamiento logra aumentar el contenido de carbono de la zona periférica, obteniéndose después, por medio de temples y revenidos, una gran dureza superficial, resistencia al desgaste y buena tenacidad en el núcleo.
Nitruración (N): al igual que la cementación, aumenta la dureza superficial, aunque lo hace en mayor medida, incorporando nitrógeno en la composición de la superficie de la pieza. Se logra calentando el acero a temperaturas comprendidas entre 400 y 525 °C, dentro de una corriente de gas amoníaco, más nitrógeno.
Cianuración (C+N): endurecimiento superficial de pequeñas piezas de acero. Se utilizan baños con cianuro, carbonato y cianato sódico. Se aplican temperaturas entre 760 y 950 °C.
Carbonitruración (C+N): al igual que la cianuración, introduce carbono y nitrógeno en una capa superficial, pero con hidrocarburos como metano, etano o propano; amoníaco (NH3) y monóxido de carbono (CO). En el proceso se requieren temperaturas de 650 a 850 °C y es necesario realizar un temple y un revenido posterior.
Sulfinización (S+N+C): aumenta la resistencia al desgaste por acción del azufre. El azufre se incorporó al metal por calentamiento a baja temperatura (565 °C) en un baño de sales.




No hay comentarios:
Publicar un comentario